
1.วิธีการเตรียมสารละลายจากสารเคมีตั้งต้นที่เป็นของแข็งและการคำนวณ
1.การอ่านฉลากขวดสารเคมีในการเตรียมสารละลายจากสารตั้งต้นที่เป็นของแข็ง จำเป็นจะต้องทราบข้อมูลของสารเคมีนั้น ๆ ก่อนโดยการอ่านฉลากที่ขวดสารเคมีอย่างละเอียด ข้อมูลที่จำเป็นสำหรับใช้ในการเตรียมสารเคมีได้แก่ ชื่อสารเคมี สูตรโมเลกุลน้ำหนักโมเลกุล ข้อมูลแสดงความบริสุทธิ์ของสารเคมี ระดับความชื้น และองค์ประกอบของสารเคมีจากตัวอย่าง

2.คำนวณหาน้ำหนักของสารเคมีที่ต้องใช้ในการเตรียมสารละลาย
3.ขั้นตอนการเตรียมสารละลาย
3.1)ชั่งสารเคมีที่เป็นของแข็งด้วยเครื่องชั่ง หากต้องการผลการทดลองที่ถูกต้องแม่นยำ ควรใช้เครื่องชั่งที่มีความละเอียดสูง ทศนิยม 3 – 5 ตำแหน่ง
หากต้องการผลการทดลองเป็นค่าประมาณ ควรใช้เครื่องชั่งที่มีความละเอียดน้อยลงมา เป็นทศนิยม 2 ตำแหน่ง โดยค่อย ๆ ตักสารเคมีออกจากภาชนะถ่าย
ใส่ลงในภาชนะรองรับเตรียมไว้สำหรับชั่ง เช่น บีกเกอร์ เป็นต้น จนได้น้ำหนักตามที่ต้องการ
3.2)นำบีกเกอร์สารออกมาจากเครื่องชั่ง เติมตัวทำละลายเล็กน้อยพอให้สารของแข็งละลายหมด ค่อย ๆ กวนสารละลายในบีกเกอร์ด้วยแท่งแก้วคนจนของแข็งละลายหมด
3.3)ถ่ายสารละลายผ่านกรวยแก้วลงในขวดวัดปริมาตร ใช้ขวดน้ำกลั่นหรือหลอดหยดฉีดตัวทำละลายชะข้างบีกเกอร์ให้ทั่ว เพื่อชะสารละลายในบีกเกอร์ลงไปให้หมด
ระวังอย่าฉีดตัวทำละลายมากเกินไปจนล้นขีดบอกปริมาตรในขวดวัดปริมาตร
3.4)ปรับปริมาตรสารละลายในขวดวัดปริมาตร หากสารละลายยังไม่เต็มขวด ให้ใช้บีกเกอร์ถ่ายตัวทำละลายลงไปจนเกือบถึงขีดบอกปริมาตร
แล้วจึงใช้หลอดหยดค่อย ๆ หยดตัวทำละลายลงไปจนถึงขีดบอกปริมาตร
3.5)ปิดฝาให้แน่นและเขย่าให้เป็นเนื้อเดียวกันโดยวิธีจับขวดกลับหัวขึ้น – ลงจนสารผสมกัน
3.6)ถ่ายสารละลายที่เตรียมเก็บไว้ในภาชะเก็บสารปิดจุกปิดฉลาดโดยระบุชื่อสาร สูตรเคมี ความเข้มข้น วันที่เตรียมสาร และวันหมดอายุถ้าม
ข้อควรระวัง
1.)ควรระมัดระวังในการใช้ขวดน้ำกลั่นเพื่อชะสารละลายในบีกเกอร์ลงในขวดวัดปริมาตร จะต้องไม่ให้ปลายหลอดฉีดน้ำสัมผัสกับภาชนะหรือสารละลายที่เตรียม
เพราะจะทำให้น้ำกลั่นขวดน้ำกลั่นเกิดการปนเปื้อน และเมื่อนำไปใช้ในการทดลองอื่น ๆ จะทำให้ได้ผลการทดลองที่ผิดพลาด
2.)ในการปรับปริมาตร เมื่อเติมสารละลายหรือน้ำกลั่นลงในขวดจนใกล้ถึงขีดวัดปริมาตร ให้ใช้หลอดหยดดูดน้ำกลั่น แล้วค่อย ๆ หยดน้ำกลั่นลงไป
เพื่อป้องกันไม่ให้ระดับของสารละลายเกินหรือพ้นขีดวัดปริมาตรขึ้นมา
3.)หากการปรับปริมาตร ระดับของสารละลายเกินขีดวัดปริมาตรแล้ว แสดงว่าความเข้มข้นของสารละลายในขวดวัดปริมาตรไม่เป็นความเข้มข้นที่ต้องการ
เพราะสารละลายเจือจางลงกว่าความเข้มที่ต้องการ จะต้องเตรียมสารละลายใหม่ หรือถ้าสารละลายที่เตรียมเป็นสารละลายมาตรฐานทุติยภูมิ
ให้นำไปทำมาตรฐานสารละลายด้วยสารละลายมาตรฐานปฐมภูมิ เพื่อหาความเข้มข้นที่แน่นอนของสารละลายที่เตรียมได้
ตัวอย่างการเตรียมสารละลายจากสารที่เป็นของแข็ง
ตัวอย่างที่1 เตรียมสารละลายโซเดียมไฮดรอกไซด์ (NaOH) ความเข้มข้น 0.20 M ปริมาตร 500มิลลิลิตร
วิธีการเตรียม
1.)คำนวณหาปริมาณโซเดียมไฮดรอกไซด์ที่ใช้

2.ชั่ง NaOH 4 g ละลายด้วยน้ำกลั่นจนของแข็งละลายหมด ค่อยถ่ายใส่ขวดวัดปริมาตรขนาด 500 มิลลิลตร ใช้ขวดน้ำกลั่นฉีดนำชะให้ทั่วบีกเกอร์
ถ่ายลงในขวดวัดปริมาตรจนแน่ใจว่า สารละลาย NaOH ในบีกเกอร์ถูกชะลงไปหมดแล้ว จึงปรับปริมาตรจนครบ 500 มิลลิลิตรด้วยกลั่น เขย่าให้เป็นเนื้อเดียวกัน
ตัวอย่างที่2 เตรียมสารละลายคอปเปอร์ทูไนเตรต ความเข้มข้น 150 ppm ปริมาตร 1 ลิตร
เนื่องจากความเข้มข้นในหน่วย ppm เป็นหน่วยที่มีความละเอียดสูง ดังนั้นการเตรียมสารละลายในหน่วยนี้จึงต้องใช้เครื่องมือและวิธีการเตรียมที่มีความถูกต้องแม่นยำมาก
การคำนวณปริมาณ Cu(NO3)2 และการปรับปริมาตรจะต้องเที่ยงตรง
วิธีการเตรียม
1.คำนวณหาน้ำหนัก Cu(NO3)2
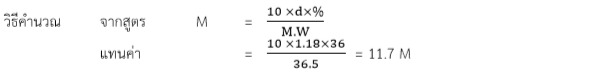
2.)ชั่ง Cu(NO3)2 0.1500 g ในบีกเกอร์ขนาดเล็ก ละลายด้วยกรด HNO3 ปริมาณเล็กน้อยจนของแข็งละลายหมด ค่อยถ่ายใส่ขวดวัดปริมาตรขนาด 1000 มิลลิลิตร
ใช้ขวดน้ำกลั่นฉีดนำชะให้ทั่วบีกเกอร์ ถ่ายลงในขวดวัดปริมาตรจนแน่ใจว่า สารละลาย Cu(NO3)2 ในบีกเกอร์ถูกชะลงไปหมดแล้ว จึงปรับปริมาตรจนครบ 1000 มิลลิลิตรด้วยกลั่น เขย่าให้เป็นเนื้อเดียวกัน
2.วิธีการเตรียมสารละลายจากสารเคมีตั้งต้นที่เป็นของเหลวและการคำนวณ
สารตั้งต้นที่เป็นของเหลวได้แก่กรดเข้มข้นต่าง ๆและสารละลายแอมโมเนียมไฮดรอกไซด์ ขั้นตอนวิธีการคำนวณและเตรียมสารละลาย มีดังนี้
1.)คำนวณหาความเข้มข้นของสารตั้งต้น
2.)คำนวณหาปริมาณสารตั้งต้นที่จะนำมาใช้เตรียมสารละลายที่ต้องการ
3.)เตรียมสารละลาย
1.)วิธีการคำนวณหาความเข้มข้นของสารตั้งต้น ข้อมูลของสารตั้งต้นที่ควรทราบดังนี้ -ความเข้มข้นในหน่วยเปอร์เซ็นต์ (%) -ความถ่วงจำเพาะ (specific gravity) หรือค่าความหนาแน่น (density, d) -มวลโมเลกุลหรือมวลสูตรของสารตั้งต้น (M.W. or F.W.)
การคำนวณความเข้มข้นของสารละลายกรดเข้มข้นในขวด ในหน่วยโมลาร์
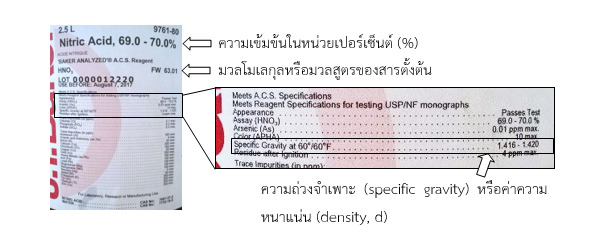
ตัวอย่าง กรดไฮโดรคลอริก (Hydrochloric acid, HCl) ซึ่งมีข้อมูลบนฉลากติดที่ข้างขวด ดังภาพ

จากข้อมูลบนฉลากข้างขวดสารพบว่า
-กรดไฮโดรคลอริก ความเข้มข้น 37 % w/w
-มวลโมเลกุลเท่ากับ 36.46 g/mol
-ความหนาแน่นเท่ากับ 1.19 g/mL หรือ 1 L = 1.19 kg
วิธีคำนวณ
สารละลาย 37 % w/w หมายความว่า
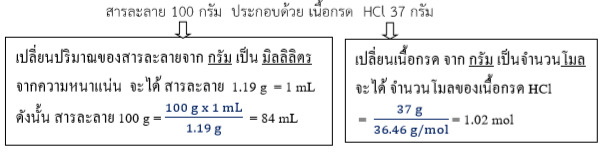
จะได้ สารละลายกรด HCl 84 mL มีเนื้อกรด 1.02 mol
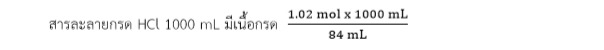
ดังนั้น กรด HCl เข้มข้นจึงมีความเข้มข้นเท่ากับ 12.1 โมลาร์
ตัวอย่างการคำนวณหาความเข้มข้นของสารตั้งต้น ดังนี้
ตัวอย่างที่3 กรดไนตริกเข้มข้น (HNO3) เมื่อกรดไนตริกเข้มข้น 70%w/w มีความหนาแน่น 1.416 g/mL M.W. = 63.01 g/mol มีความเข้มข้นกี่โมลาร์
วิธีคำนวณ
ในสารละลายกรด 1 mL จะมีน้ำหนักกรด 1.413 g
ดังนั้น ในสารละลายกรด 1000 mL จะมีน้ำหนักกรด 1413 g
เนื่องจาก ในสารละลายกรด HNO3 100 g จะมีเนื้อกรดอยู่เพียง 70 g
ดังนั้น เนื้อกรด HNO3 1413 g
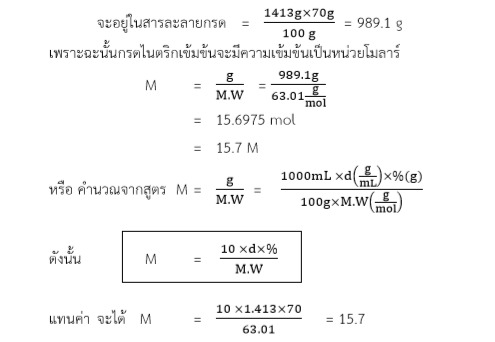
ตัวอย่างที่4 กรดไฮโดรคลอริก เข้มข้น 36%w/w ความหนาแน่น 1.18 g/mL
น้ำหนักโมเลกุล 36.5 g/mol มีความเข้มข้นกี่โมลาร์
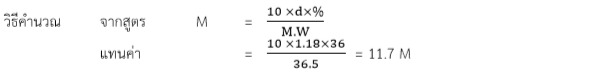
ตัวอย่างที่5 แอมโมเนียมไฮดรอกไซด์ เข้มข้น 28%w/w ความหนาแน่น 0.91 g/mL น้ำหนัก
โมเลกุล 17.031 g/mol มีความเข้มข้นกี่โมลาร์
วิธีคำนวณ ในกรณีใช้มวลโมเลกุลของ NH3

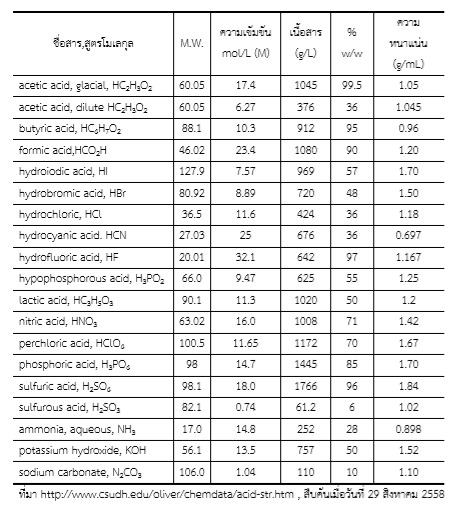
ตารางที่1 แสดงข้อมูลความเข้มข้นของกรดเข้มข้นชนิดต่าง ๆ
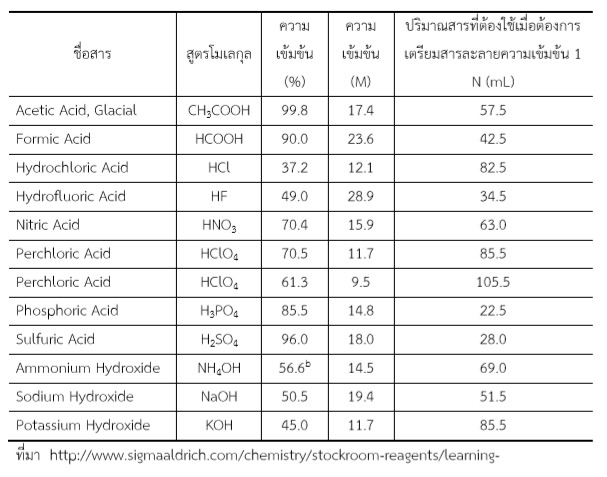
ตารางที่2 แสดงข้อมูลสำหรับการเตรียมสารละลายกรดต่าง ๆ แอมโอเนียมไฮดรอกไซด์
โพแตสเซียมไฮดรอกไซด์ และ โซเดียมไฮดรอกไซด์ ความเข้มข้น 1 N ปริมาตร 1 ลิตร
2 คำนวณหาปริมาณสารตั้งต้นที่จะนำมาใช้เตรียมสารละลายที่ต้องการ คำนวณหาปริมาณสารตั้งต้นที่จะนำมาใช้เตรียมสารละลายที่ต้องการ และเตรียมสารละลายด้วยวิธีการเจือจาง
การเตรียมสารละลายโดยวิธีเจือจางสารละลาย การเจือจางสารละลาย มีจุดประสงค์เพื่อเจือจางสารละลายที่มีความเข้มข้นกว่าให้มีความเข้มข้นน้อยลง
หรือมีความเข้มข้นตามที่ต้องการ ใช้สูตรคำนวณ คือ
เมื่อ
C1 = ความเข้มข้นของสารละลายตั้งต้น
V1 = ปริมาตรของสารตั้งต้นที่ต้องใช้ในการเจือจาง
C2 = ความเข้มข้นของสารละลายที่ต้องการเจือจาง
V2 = ปริมาตรของสารละลายที่ต้องการเจือจาง
โดยปกติเราจะทราบความเข้มของสารละลายตั้งต้นอยู่แล้ว ดังนั้นสิ่งที่ต้องคำนวณหาคือ ปริมาตรของสารตั้งต้นที่ต้องใช้ในการเจือจาง
3. ขั้นตอนการเจือจางสารละลาย 1.เตรียมสารละลายตั้งต้น (Stock solution) 2.คำนวณหาปริมาตรของสารตั้งต้นที่ต้องใช้ในการเจือจาง 3.เจือจางสารละลายโดยการตวงสารละลายตั้งต้นตามปริมาตรที่คำนวณได้ ถ่ายลงในภาชนะที่ใช้สำหรับเตรียม 4.ปรับปริมาตรด้วยตัวทำละลายและเขย่าให้เป็นเนื้อเดียวกัน
ตัวอย่างการคำนวณหาความเข้มข้นสารตั้งต้น ปริมาตรของสารตั้งต้นที่ต้องการใช้เตรียมสารละลายใหม่ และวิธีการเจือจางสารละลาย
ตัวอย่างที่6 เตรียมสารละลายกรดอะซิติก ความเข้มข้น 4% v/v ปริมาตร 2 ลิตร จากสารละลายของกรดอะซิติก ความเข้มข้น 99.8 % w/w
ความเข้มข้นหน่วยเป็นเปอร์เซ็นต์ เป็นหน่วยความเข้มข้นที่ไม่ต้องการผลการทดลองที่แม่นยำ เป็นเพียงผลประมาณการ ดังนั้นจึงไม่จำเป็นต้องเตรียมด้วยอุปกรณ์มาตรฐานหรือปรับปริมาตรที่แม่นยำมากนัก
กรดอะซิติกเข้มข้น จะมีความเข้มข้นต่ำกว่า 100% w/w เล็กน้อย คือประมาณ 99.8 % w/w ดังนั้นจึงเทียบได้ว่ากรดอะซิติกเข้มข้น มีความเข้มข้น 100% v/v
ขั้นตอนการเจือจางสารละลาย
1.คำนวณหาปริมาณกรดอะซิติกเข้มข้นที่ต้องใช้ในการเจือจาง
จากสูตร C1V1 = C2V2
V1 = (4% x 2000mL)/100% = 80 mL
ปริมาตรของกรดอะซิติกเข้มข้นที่ต้องใช้เท่ากับ 80 มิลลิลิตร 2.)ตวงกรดอะซิติกเข้มข้น 80 มิลลิลิตรด้วยใช้กระบอกตวงขนาด 100 มิลลิลิตร ถ่ายลงในขวดวัดปริมาตรขนาด 2000 มิลลิลิตร ที่มีน้ำกลั่นอยู่ประมาณครึ่งขวด จากนั้นปรับปริมาณให้ได้ 2000 มิลลิลิตร เขย่าให้เป็นเนื้อเดียวกัน