
สารละลายบัฟเฟอร์ หมายถึง สารละลายที่มีความสามารถในการควบคุมระดับ pH เอาไว้ได้ เมื่อเติมสารละลายกรดหรือเบสจำนวนที่ไม่มากเกินไป เมื่อเปรียบเทียบกับน้ำบริสุทธิ์ที่เติมกรดหรือเบสจำนวนเท่ากัน สารละลายที่มีสมบัติเป็นสารละลายบัฟเฟอร์จะควบคุมระดับ pH เอาไว้ได้ดีกว่าน้ำกลั่น สารละลายบัฟเฟอร์เกิดจากการผสมระหว่างสารละลายกรดอ่อนกับเกลือของกรดอ่อนนั้น หรือสารละลายเบสอ่อนกับเกลือของเบสอ่อนนั้น แม้ว่าสารละลายบัฟเฟอร์จะควบคุมระดับ pH เอาไว้ได้ดีกว่าน้ำกลั่น แต่ถ้าเติมกรดหรือเบสมากเกินไป สารละลายบัฟเฟอร์ก็จะไม่สามารถควบคุมระดับ pH เอาไว้ได้ตลอด ในที่สุดจะเสียสมบัติในการเป็นสารละลายบัฟเฟอร์ไป เราเรียกความสามารถในการควบคุมระดับ pH ของสารละลายบัฟเฟอร์ว่า buffer capacity
สารละลายบัฟเฟอร์มี 2 ประเภท
1) บัฟเฟอร์กรด (Acid buffer solution) เกิดจากสารละลายของกรดอ่อนผสมกับสารละลายเกลือของกรดอ่อนชนิดนั้น สารละลายบัฟเฟอร์ประเภทนี้มี pH < 7 เช่น
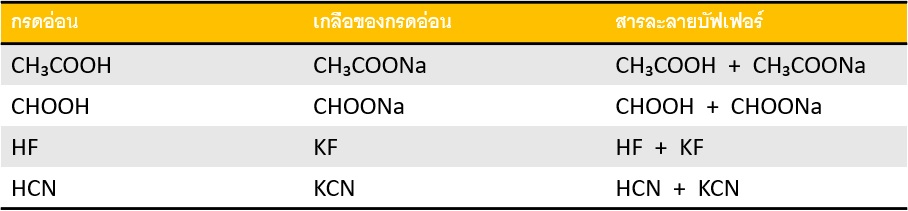
2) บัฟเฟอร์เบส (Basic buffer solution) เกิดจากสารละลายของเบสอ่อนผสมกับสารละลายเกลือของเบสอ่อนนั้น สารละลายบัฟเฟอร์แบบนี้ มี pH > 7 เช่น

วิธีเตรียมสารละลายบัฟเฟอร์
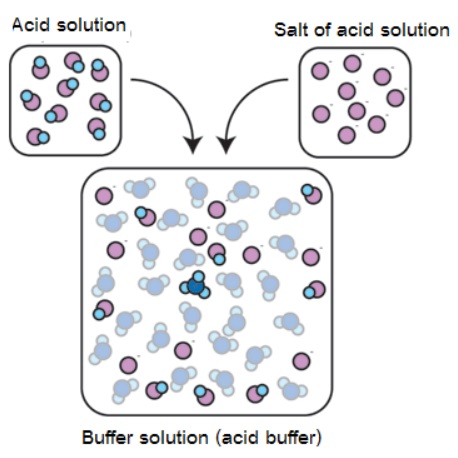
1. เตรียมโดยตรงจากการผสมสารละลายของกรดอ่อนกับสารละลายเกลือของกรดอ่อนนั้น หรือผสมสารละลายของเบสอ่อนกับสารละลายเกลือของเบสอ่อนนั้น ดังรูป
2. เตรียมจากปฏิกิริยาระหว่างกรดกับเบส
2.1 บัฟเฟอร์กรด เตรียมโดยใช้สารละลสยของกรดอ่อนที่มากเกินพอ ทำปฏิกิริยากับเบส (แก่หรืออ่อนก็ได้ แต่ต้องมีจำนวนน้อยกว่ากรดอ่อนจนถูกใช้หมด) เช่น
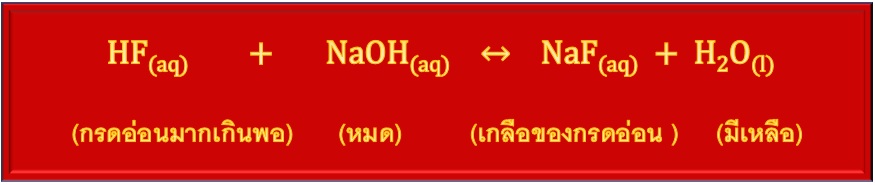
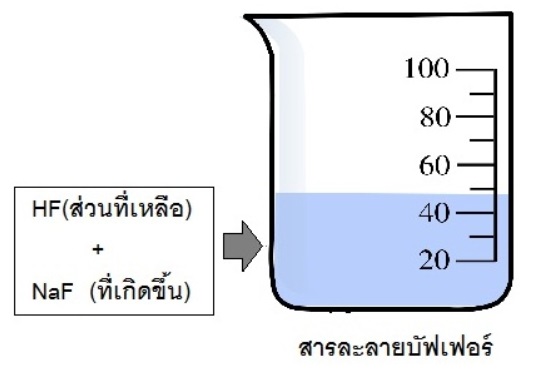
ถ้าใช้ HF มากเกินพอจะมี HF เหลืออยู่ เมื่อเกิดปฏิกิริยาจนสมบูรณ์แล้ว NaOH จะหมดไป ในระบบจะเป็นสารละลายผสมระหว่างHF ส่วนที่เหลือ กับ NaF ที่เกิดขึ้น
จึงเป็นบัฟเฟอร์กรด (กรดอ่อน+เกลือของกรดอ่อนนั้น) ดังรูป
2.2 บัฟเฟอร์เบส เตรียมโดยใช้สารละลายเบสอ่อนที่มากเกินพอ ทำปฎิกิริยากับสารละลายกรดกรด (แก่หรืออ่อนก็ได้ แต่ต้องมีจำนวนน้อยกว่าเบสอ่อนจนถูกใช้หมด) เช่น
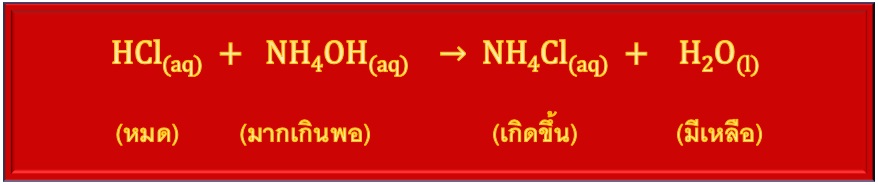
เมื่อเกิดปฏิกิริยาสมบูรณ์แล้ว HCl จะหมดไปแต่ NH4OH ยังมีเหลือ ฉะนั้นในระบบจะเป็นสารละลายผสมระหว่าง NH4OH สว่นที่เหลือ กับ NH4Cl ที่เกิดขึ้น จึงเป็นสารละลายบัฟเฟอร์เบส (เบสอ่อน + เกลือของเบสอ่อนนั้น)
การควบคุมค่า pH ของสารละลายบัฟเฟอร์
ส่วนประกอบของสารละลายบัฟเฟอร์ จะแตกต่างจากสารละลายของกรดอ่อนหรือเบสอ่อน คือ ในสารละลายกรดอ่อนจะมีอนุภาคของกรดอ่อนละลายอยู่มาก แต่อนุภาคของคู่เบสมีน้อย เช่น

แต่เมื่อผสมสารละลายเกลือของ CH3COOH เช่น CH3COONa ซึ่งเป็นสารไอออนิกที่ละลายน้ำได้ดี แตกตัวเป็นไอออนได้ทั้งหมด จึงมี CH3COO- อยู่เป็นจำนวนมาก ดังนี้
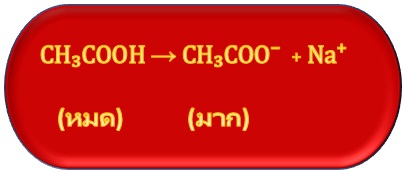
เมื่อนำมาผสมกันจะมีสมบัติเป็นสารละลายบัฟเฟอร์ ให้สังเกตว่าในสารละลายจะมีกรดอ่อนและคูเบสของกรดอ่อนเป็นจำนวนมากทั้งคู่ ดังสมการ
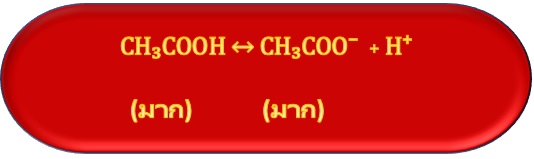
การที่ในสารละลายมี กรดอ่อนและคู่เบสของกรดอ่อนนั้นอยู่เป็นจำนวนมาก ทำให้สามารถควบคุมระดับความเป็นกรด-เบสของสารละลายเอาไว้ได้จึงมีสมบัติเป็นสารละลายบัฟเฟอร์ เพราะ
- เมื่อเติมกรด (H+) กรดหรือ H+ ที่เติมลงไปก็จะรวมตัวกับ CH3COO- เกิดปฏิกิริยาย้อนกลับเปลี่ยนให้อยู่ในรูป CH3COOH ได้เกือบทั้งหมด ทำให้ความเข้มข้น H+ เพิ่มขึ้นน้อยกว่า จำนวนที่เติมลงไปจริง pH จึงแปลี่ยนแปลงน้อยกว่าปริมาณของ H+ ที่เติมลงไปจริง
- เมื่อเติมเบส (OH-) เบสหรือ OH- ที่เติมลงไปก็จะรวมตัวกับ H+ เปลี่ยนให้มาอยู่ในรูป H2O ทำให้ H+ ลดลงในตอนแรก แต่ในเวลาเดียวกัน CH3COOH ซึ่งมีอยู่มาก (สังเกตทางซ้ายของสมการ)ก็จะเกิดการแตกตัวให้ H+ มาทดแทนได้เกือบทั้งหมด ทำให้ปริมาณของ H+ จึงลดลงน้อยกว่าปริมาณของ OH- ที่เติม pH จึงเปลี่ยนแปลงน้อยกว่าปริมาณของ OH- ที่เติมลงไปจริง
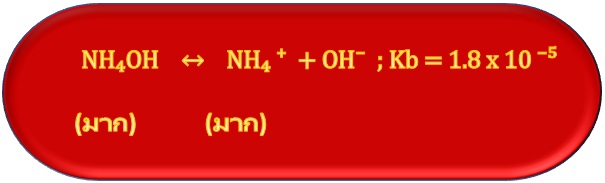
สำหรับสารละลายบัฟเฟอร์เบสก็จะมีลักษณะเช่นเดียวกัน คือเบสอ่อนแตกตัวได้น้อย เช่น การละลายของ NH4OH ดังสมการ ;
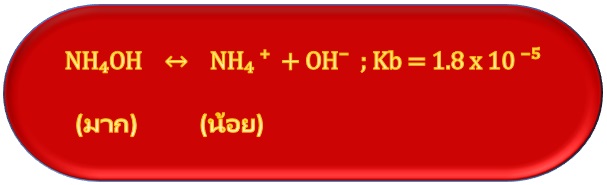
แต่สำหรับเกลือของเบสชนิดนี้ เช่น NH4Cl จะละลายน้ำได้ดี ดังสมการ
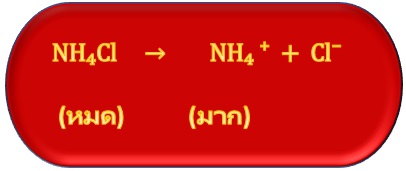
เมื่อผสมสารละลายของเบสอ่อนกับสารละลายเกลือของเบสอ่อนเข้าด้วยกัน ในสารละลายที่ได้จากการผสมก็จะมีมากทั้งตัวของเบสอ่อนลัคู่กรดของมัน จึงมีสมบัติเป็นสารละลายบัฟเฟอร์ ดังสมการ
การหา pH ของสารละลายบัฟเฟอร์
1. สารละลายบัฟเฟอร์กรดหา pH จากสมการ

ตัวอย่าง สารละลายบัฟเฟอร์ประกอบด้วย สารละลายกรดอะซิติกกับสารละลายโซเดียมอะซิเตต ซึ่งเข้มข้น 0.1 โมล/ลิตรเท่ากันและมีปริมาตร 100 cm3 เท่ากันด้วย ถ้า Ka ของกรดอะซิติกเท่ากับ
1.8 x 10-5 จงหา pH ของสารละลายบัปเฟอร์นี้
วิธีทำ

= -log 1.8 x 10-5 + log (0.1 / 0.1 )
= 5 – log 1.8 + log 1
= 5 – 0.26
= 4.24
2. สารละลายบัฟเฟอร์เบส หา pH ได้ดังนี้

จากนั้นจึงหา pH จากสมการ
pH = 14 –pOH
ตัวอย่าง สารละลายบัฟเฟอร์ที่เกิดจากผสมสารละลายเบสอ่อน NH4OH และเกลือ NH4Cl ซึ่งมีความเข้มข้น 0.1 โมล/ลิตรเท่ากัน และมีปริมาตร 100cm3 เท่ากันด้วย ถ้า Kb ของ NH4OH
เท่ากับ 1.8 x 10-5 สารละลายบัฟเฟอร์นี้มี pH เท่าไร

= - log 1.8 x 10-5 + log (0.1 / 0.1 )
= 5 – log 1.8 +log 1
= 5 – 0.26
= 4.74
pH = 14 – pOH
= 14 – 4.74
= 9.26