
กราฟมาตรฐาน
กราฟมาตรฐาน (calibration curve) หรือกราฟความเข้มข้นมาตรฐาน (concentration calibration curve) จัดเป็นการสอบเทียบมาตรฐานทางอ้อม ซึ่งกราฟที่สร้างขึ้นเป็นความสัมพันธ์ระหว่างสัญญาณ ตอบสนองที่วัดได้ (แกน y) กับความเข้มข้นของสารที่สนใจวิเคราะห์(analyte) ที่เตรียมเป็นสารมาตรฐาน (แกน x) โดยสัญญำณตอบสนองที่วัดได้ต้องแปรผันโดยตรงกับปริมาณสารที่สนใจวิเคราะห์(analyte) การสร้างกราฟมาตรฐานจึงเป็นวิธีการสร้างความสัมพันธ์เชิงเส้นตรงระหว่างความเข้มข้นของสารมาตรฐานที่ทราบความเข้มข้น (หรือปริมาณ) กับสัญญาณตอบสนองที่ได้จากเครื่องมือวิเคราะห์ซึ่ง สามารถสร้างกราฟมาตรฐานหลายวิธีด้วยกัน ดังนี้1. วิธีสารมาตรฐานภายนอก (External standard)
การสร้างกราฟมาตรฐานภายนอก จะต้องกำหนดช่วงความเข้มข้นให้เหมาะสม โดยควรเป็น ช่วงความเข้มข้นที่สัมพันธ์กับสัญญาณที่วัดได้มีความเป็นเส้นตรงมากที่สุด เรียกว่า ช่วงความเป็น เส้นตรง (linearity range) โดยเครื่องมือบางประเภทจะมี cook book ระบุสัญญาณตอบสนองที่ใช้สอบ เทียบสภาพไว จึงอาจนำมาเป็นแนวทางในการเตรียมชุดสารละลายมาตรฐานเพื่อสร้างกราฟมาตรฐาน ได้ ส่วนเครื่องมือที่ไม่มี cook book ผู้วิเคราะห์ต้องทดลองหาช่วงความเข้มข้นจากสัญญาณของ เครื่องมือ วิธีกำรสร้างกราฟมาตรฐานภายนอกมีขั้นตอนดังนี้
1.1) เตรียมสารละลายมาตรฐานที่มี analyte ในความเข้มข้นแตกต่างกัน 4-5 ความ เข้มข้น และ แบลงค์ (blank) โดยอาจใช้ reagent blank ซึ่งเตรียมตามกระบวนการเดียวกับสารละลาย มาตรฐานเพียงแต่ไม่มี analyte เป็นองค์ประกอบ หรืออาจใช้ตัวทำละลายเป็นแบลงค์
1.2) ทำการปรับศูนย์ด้วยแบลงค์และวิเคราะห์สารละลายมาตรฐานด้วยเครื่องมือ นาสัญญาณตอบสนองมาเขียนกราฟแสดงความสัมพันธ์ระหว่างสัญญาณ (แกน y) กับความเข้มข้นของ analyte (แกน x) และหาสมการเส้นตรงของกราฟ ลักษณะกราฟมาตรฐานแสดงดังภำพที่ 1
1.3) เตรียมสารละลายตัวอย่างเช่นเดียวกับกระบวนเดียวกับการเตรียมสารละลาย มาตรฐาน โดยอาจต้องทำละลาย ย่อย หรือเจือจางสารตัวอย่างก่อนเตรียมสารละลายตัวอย่าง
1.4) วิเคราะห์สารละลายตัวอย่าง แทนค่าผลลัพธ์หรือสัญญำณที่ได้ในสมการ เส้นตรงเพื่อคำนวณเป็นความเข้มข้นของสารละลายตัวอย่ำง แล้วคำนวณกลับเป็นความเข้มข้นของตัวถูกละลายในสารตัวอย่างจริง
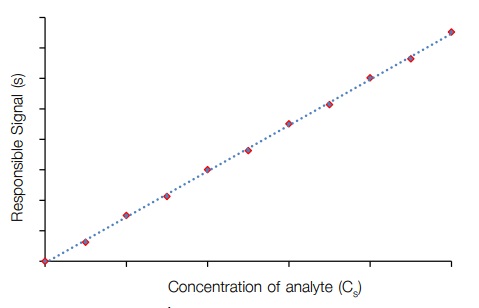
เมื่อทำการวิเคราะห์สารตัวอย่าง ความเข้มข้นของสารตัวอย่างที่วิเคราะห์ควรอยู่ในช่วงความ เป็นเส้นตรงของกราฟมาตรฐาน โดยสัญญาณที่วัดได้ต้องไม่ต่ำกว่าสัญญาณที่วัดได้ของความเข้มข้นของ สารมาตรฐานตัวที่มีความเข้มข้นน้อยที่สุด ในกรณีที่สารตัวอย่างมีสัญญาณต่ำกว่า อาจต้องทำการเพิ่ม ความเข้มข้น (pre-concentration) ก่อน แต่ถ้าสัญญาณสูงกว่าสัญญาณที่วัดได้ของความเข้มข้นของสาร มาตรฐานตัวที่สูงที่สุด จะต้องทำการเจือจาง (dilution) ให้ความเข้มข้นอยู่ในช่วงความเป็นเส้นตรง
วิธี external standard นิยมใช้กันมากที่สุดในการวิเคราะห์เชิงปริมาณ เนื่องจากทำได้ง่าย โดยใช้ สารละลายมาตรฐานเพียงชุดเดียว จึงเหมาะสำหรับงานวิเคราะห์ประจำ (routine analysis) ที่วิเคราะห์ สารตัวอย่างจำนวนมาก อย่างไรก็ตาม วิธี external standard ก็มีข้อจำกัดที่ก่อให้เกิดความคลาดเคลื่อน เชิงระบบ เนื่องจากเมทริกซ์ของสารละลายตัวอย่างจะไม่เหมือนกับเมทริกซ์ของสารละลายมาตรฐาน และแบลงค์ (blank) ได้ทั้งหมดทุกส่วน และการเตรียมสารละลายตัวอย่างจากตัวอย่างจริงเพื่อให้เมท ริกซ์ใกล้เคียงกับสารละลายมาตรฐานที่สุดอาจทำให้เกิดการปนเปื้อน (contaminate) หรือสูญเสียสารที่ สนใจวิเคราะห์จากสารตัวอย่าง
ในที่นี้ขอยกตัวอย่างกราฟมาตรฐานของเทคนิคการวัดการดูดกลืนแสง จากกฎของเบียร์ “ค่ำ การดูดกลืนแสง (absorbance) เป็นสัดส่วนโดยตรงกับความเข้มข้นของสารที่สนใจที่สามารถดูดกลืนแสง ได้ (absorbing analyte species)” ดังนั้นเมื่อนำความสัมพันธ์ระหว่างความเข้มข้นของสารที่สนใจและค่า การดูดกลืนแสงมาสร้างกราฟ จะได้ความสัมพันธ์เชิงเส้นตรง เรียกว่า กราฟความเข้มข้นมาตรฐาน (calibration curve) เมื่อค่าการดูดกลืนแสง (absorbance, A) เป็นแกน y และความเข้มข้น (concentration, C) เป็นแกน y จะได้กราฟเส้นตรงที่มีค่าความชันเท่ากับ Ԑb และเมื่อ b เท่ำกับ 1 ความชันจึงเท่ากับ Ԑ ดังแสดงในภำพที่ 2
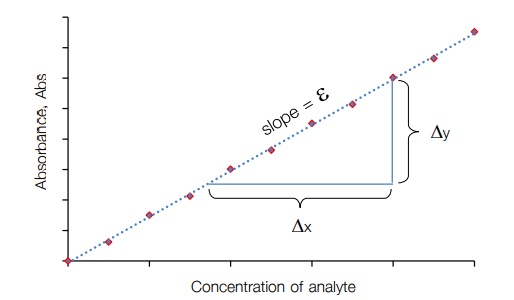
จุดประสงค์ที่สำคัญของการทำกราฟความเข้มข้นมาตรฐานเพื่อให้ได้สัญญาณการดูดกลืนแสง จากเครื่องมือวัดในขณะนั้น เมื่อใช้ความเข้มข้นของสารมาตรฐาน (external standard solution) ที่ความ เข้มข้นต่างกันตามลำดับ (concentration series) สัญญาณการดูดกลืนแสงที่ได้จะเป็นสัดส่วนโดยตรงกับ ความเข้มข้นตามกฎของเบียร์ และที่สำคัญกราฟความเข้มข้นมาตรฐานจะเป็นเครื่องมือในการหาความ เข้มข้นของสารที่สนใจในสารตัวอย่ำง โดยอำศัยสมการเส้นตรงของกราฟความเข้มข้นมาตรฐาน
วิธีการสร้างกราฟความเข้มข้นมาตรฐาน ทำได้โดยนำสารละลายมาตรฐาน (standard solution) ที่ทราบค่าความเข้มข้นที่แน่นอนอย่างน้อย 4-5 ความเข้มข้น มำวัดค่าการดูดกลืนแสง จากนั้นนำค่าการ ดูดกลืนแสงที่ได้ของแต่ละความเข้มข้นได้เขียนกราฟระหว่างความเข้มข้นกับค่าการดูดกลืนแสง จะได้ กราฟความเข้มข้นมาตรฐำน ส่วนสารตัวอย่างเราไม่ทราบความเข้มข้นของสารที่สนใจ เมื่อนำไปวัดค่า การดูดกลืนแสงที่ความยาวคลื่นเดียวกับวิธีการทำกราฟความเข้มข้นมาตรฐาน เครื่องมือจะรายงานค่า การดูดกลืนแสงของสารตัวอย่าง จากนั้นนำค่าการดูดกลืนแสงของสารตัวอย่างไปหาความเข้มข้นของ สารตัวอย่างโดยอาศัยสมการเส้นตรง เราจะทราบค่าความเข้มข้นของสารที่สนใจในสารตัวอย่างได้
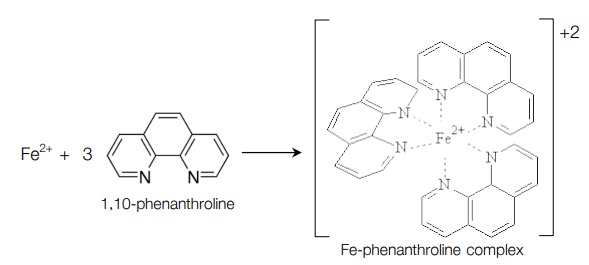
ตัวอย่างการวิเคราะห์ปริมาณเหล็กด้วยวิธีวัดค่าการดูดกลืนแสง ทำได้โดยให้เกิดไอออนเชิงซ้อน ที่มีสี (สีแดงถึงส้ม) ระหว่าง Fe2+ กับ 1,10-phenanthroline ที่เรียกว่าไอออนเชิงซ้อนเหล็กฟีแนนโทรลีน (Fe-Phen) ซึ่งดูดกลืนแสงที่ความยาวคลื่น 510 nm โดยควบคุม pH ด้วยสารละลายบัพเฟอร์ประมาณ pH 3.5 เพื่อป้องกันไม่ให้เกิดตะกอนเป็น Fe(OH)2 และจะต้องเติมตัวรีดิวซ์เพื่อทำการรีดิวซ์เหล็กทั้งหมด ในสารละลายให้เป็น Fe2+ เสียก่อนโดยใช้สารละลายไฮดรอกซีลามีนไฮโดรคลอไรด์ (hydroxylamine hydrochloride) สีของไอออนเชิงซ้อนระหว่างเหล็ก(II) กับฟีแนนโทรลีนจะเสถียรได้นาน
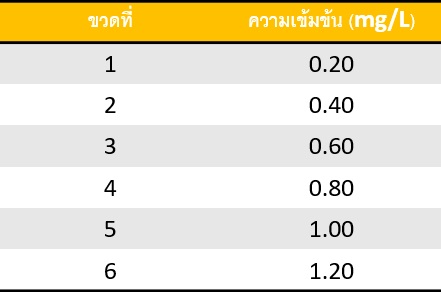
การเตรียมกราฟความเข้มข้นมาตรฐานทำได้โดย เตรียมสารละลายเหล็กมาตรฐานให้มีความ เข้มข้นแตกต่างกันเป็นลำดับจำนวน 6 ความเข้มข้นในขวดวัดปริมาตร (ในการเตรียมชุดสารละลาย มาตรฐานจะต้องไม่มีความคลาดเคลื่อนเกี่ยวกับการเตรียม เช่นปริมาตรที่ปิเปตและการปรับปริมาตร สุดท้าย) ความเข้มข้นของเหล็กที่เตรียมดังตารางที่ 1
ตารางที่ 1ความเข้มข้นของเหล็ก(II) สำหรับทำกราฟความเข้มข้นมาตรฐาน
จากนั้นเติมสารละลาย NH2OH.HCl และแอซิเตตบัฟเฟอร์(acetate buffer) อย่างละ 1 mL ลง ไป แล้วเติม 1,10-phenanthrolien ปริมาตร 2 mL แล้วเติมน้ำกลั่นลงใปจนครบขีดปริมาตร (ขวดวัด ปริมาตร 50 mL) เขย่าให้เข้ากันแล้วตั้งทิ้งไว้ 10 นำทีจะได้สารละลายสีส้มแดงของไอออนเชิงซ้อนดัง ภาพที่ 4 จากนั้นนำสารละลายแต่ละขวดไปวัดค่าการดูดกลืนแสงที่ 517 nm ได้ผลดังตารางที่ 2

ตารางที่ 2 ค่าการดูดกลืนแสงของไอออนเชิงซ้อนเหล็กฟีแนนโทรลีน
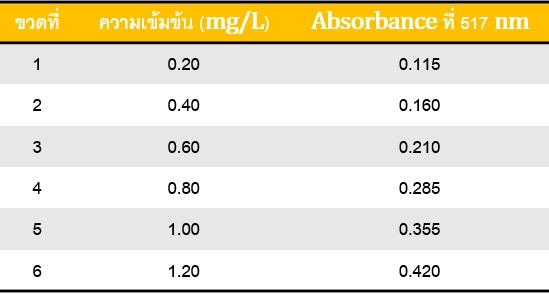
จากนั้นนำค่าการดูดกลืนแสงของแต่ละความเข้มข้นมาเขียนกราฟระหว่างความเข้มข้นของ เหล็กกับค่าการดูดกลืนแสงของไอออนเชิงซ้อนเหล็กฟีแนนโทรลีน จะได้กราฟเส้นตรงดังภาพที่ 5
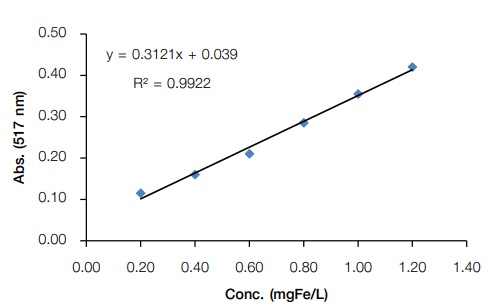
กราฟมาตรฐานที่สร้างโดยใช้โปรแกรม MS excel จะได้ข้อมูลเกี่ยวกับสมการเส้นตรงที่บอกค่า ความชัน (slope) และจุดตัดแกน y (intercept-y) และยังสามารถบอกความเป็นเส้นตรงว่ากราฟนั้นมี ความเป็นเส้นตรงมากน้อยเพียงใด ถ้าค่า R2 ใกล้1 แสดงว่ากราฟนั้นมีความเป็นเส้นตรงสูง โดยทั่วไป ในการวิเคราะห์เชิงปริมำณค่า R2 ต้องมากกว่า 0.99 ซึ่งจากกราฟเส้นตรงของไอออนเชิงซ้อนเหล็ก ฟีแนนโทรลีน พบว่า ค่าความชัน = 0.3121 จุดตัดแกน y = 0.039 และ R2= 0.9925
จากตัวอย่างกราฟมาตรฐานของไอออนเชิงซ้อนเหล็กฟีแนนโทรลีน (ภาพที่ 5) ถ้าสมมตินำ สารตัวอย่างน้ำบาดาล ปริมาตร 5.00 mL เติมสารละลายเช่นเดียวกับการเตรียมกราฟ และวัดค่าการ ดูดกลืนแสงที่ 517 nm ได้เท่ากับ 0.380 เราสามารถคำนวณปริมาณเหล็กในสารตัวอย่างเทียบกับเตรียม กราฟความเข้มข้นมาตรฐาน โดยอาศัยสมการเส้นตรง


เมื่อ y คือค่าการดูดกลืนแสงของสารที่สนใจในตัวอย่าง เท่ากับ 0.380 ดังนั้น

แต่สารละลายตัวอย่างที่วิเคราะห์นี้ ได้จากการเจือจางสารตัวอย่าง 5 mL ให้ได้สารละลาย 50 mL (dilution factor = 10) ดังนั้นความเข้มข้นของ Fe ในตัวอย่าง
Fe = 1.09 mgFe/L x 10 = 10.9 mg/L
ดังนั้น สรุปได้ว่าในสารตัวอย่างมีปริมาณเหล็กเท่ากับ 10.9 mg/L (ppm)
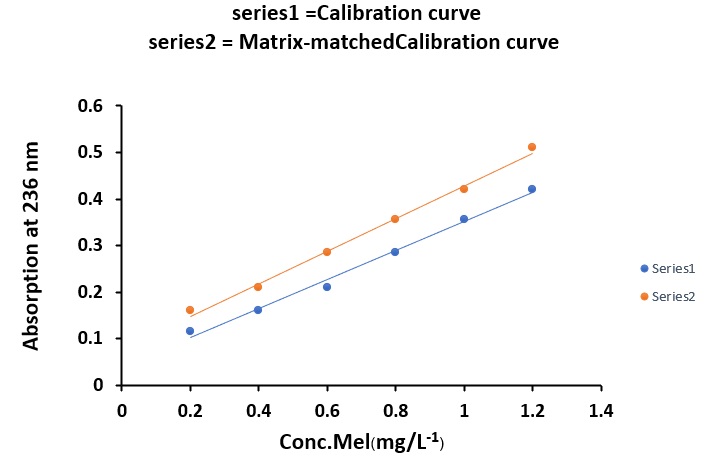
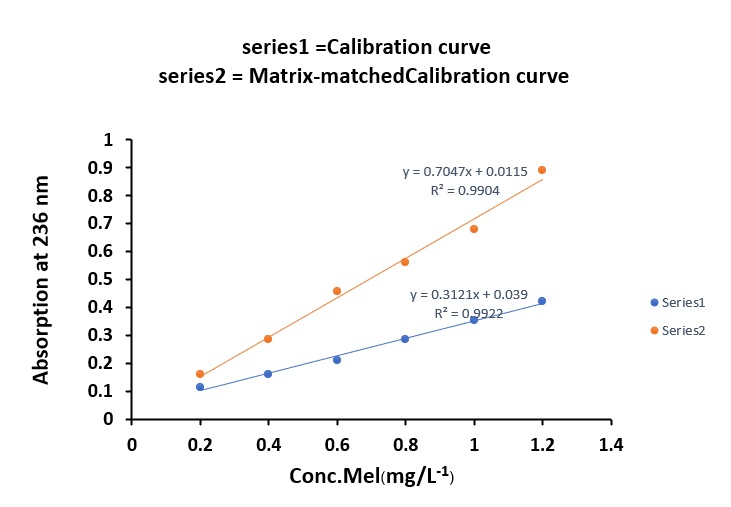
แต่ในกรณีที่ตัวอย่างอาจสิ่งรบกวน (matrix) หรือสิ่งเจือปนที่ทำให้องค์ประกอบส่วนใหญ่นั้น แตกต่างจากสารมาตรฐาน และสิ่งรบกวนเหล่านั้นอาจมีผลต่อการดูดกลืนแสงทั้งบวกหรือทางลบ เรา สามารถทำการเติมสารมาตรฐานแล้วทำการวัดค่าการดูดกลืนแสง เรียกว่าวิธี matrix-matched calibration โดยวิธีนี้สามารถบ่งชี้ถึงผลของสิ่งรบกวนโดยดูจากกราฟเส้นตรง โดยถ้ากราฟระหว่างกราฟ ความเข้มข้นมาตรฐานกับ matrix-matched calibration มีความชันเท่ากันหรือใกล้เคียงกัน เส้นกราฟจะ ขนานกัน อธิบายได้ว่าผลของสิ่งรบกวนในสารตัวอย่างไม่มีผลต่อการวิเคราะห์ เช่นการพัฒนาวิธีการ วิเคราะห์เมลามีนในนมผง(2) ดังภาพที่ 6 แต่ถ้าความชันไม่เท่ากันหรือไม่ใกล้เคียงกัน เส้นกราฟจะไม่ ขนานกัน(3) (ภาพที่ 7) อธิบายได้ว่าสิ่งรบกวนหรือสารเจือปนในสารตัวอย่างมีผลต่อการวิเคราะห์อย่างมี นัยสำคัญ

วิธีเติมสารมาตรฐาน (Standard addition) หรือเรียกอีกอย่างว่า spiked method เป็นอีกวิธีที่ นิยมใช้ในการวิเคราะห์เชิงปริมาณของสารที่สนใจที่มีสารที่มีเมทริกซ์เจือปนมาก (matrix effect) ซึ่ง อาจจะมีผลต่อการวิเคราะห์ได้และไม่อาจใช้วิธี matrix-matched calibration ได้โดยหลักการของวิธีนี้ คือการเติมสารละลายมาตรฐานที่ทราบความเข้มข้นที่แน่นอนลงในสารตัวอย่างจะทำการวิเคราะห์สารที่ สนใจ โดยขั้นตอนวิธีเติมสารละลาย ทำได้ดังนี้
2.1) เตรียมสารละลายตัวอย่างที่ไม่ทราบความเข้มข้น (Cx) ปริมาตรแน่นอน (Vx) เท่ากัน ในขวดวัดปริมาตรอย่างน้อย 5 ขวด
2.2) เติมสารละลายมาตรฐานที่ทราบความเข้มข้น (Cs ) ปริมาตรที่แตกต่างกันเป็นลำดับ (Vs )
2.3) เติมสารอื่นๆ ที่เกี่ยวข้องในปฏิกิริยา ให้เท่ากันทุกๆ ขวด และปรับปริมาตรด้วยตัว ทำละลาย (ปริมาตรรวม Vt )
2.4) ทำการปรับศูนย์ด้วยแบลงค์และวิเคราะห์สารละลายมาตรฐานที่เติมสารตัวอย่าง (spiked sample) ด้วยเครื่องมือ ได้สัญญาณตอบสนองเป็น S นำสัญญาณตอบสนอง (S) มาเขียนกราฟ แสดงความสัมพันธ์ระหว่างสัญญาณตอบสนอง (แกน y) กับความเข้มข้นของ analyte (แกน x) จะได้ ลักษณะกราฟมาตรฐานจากวิธีเติมสารมาตรฐานแสดงดังภาพที่ 8 สัญญาณตอบสนอง (S) ที่ได้จะเป็นผลรวมของสัญญาณจากสารตัวอย่างกับสารมาตรฐานที่เติม ลงไป ดังนี้

จากสมการ (4) ถ้าเขียนกราฟระหว่าง S กับ Vs จะได้กราฟเส้นตรง ดังภาพที่ 8 โดยมี
ความชัน คือ

จุดตัดแกน y คือ

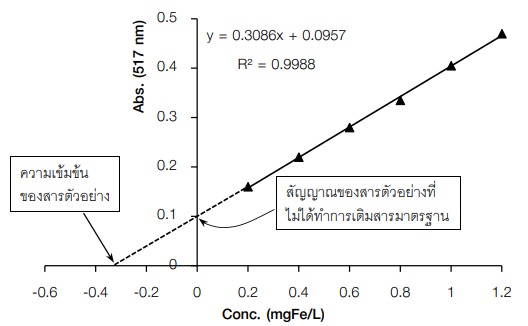
สารตัวอย่างที่ไม่ทราบความเข้มข้น (Cx) สามารถหาความเข้มข้น ได้ดังนี้

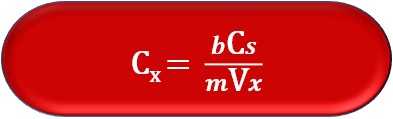
จากกราฟภาพที่ 8 เมื่อลากเส้นต่อจากเส้นตรงไปตัดแกน y ที่จุดตัดแกน y จะเป็นสัญญาณของ สารตัวอย่างที่ไม่ได้ทำการเติมสารมาตรฐาน (Sx ) และที่จุดตัดแกน x จะเป็นความเข้มข้นของสารที่สนใจ ในสารตัวอย่าง (Cx ) ดังนั้น สมการ (4) เมื่อสัญญาณรวมเป็นศูนย์ เราสามารถคำนวณความเข้มข้นของ สารตัวอย่างได้ดังสมการ (10)


ข้อดีวิธีstandard addition
คือสามารถลดผลจากเมทริกซ์และตัวรบกวนที่อาจส่งผลกระทบต่อ การวิเคราะห์เนื่องจากในสารละลายมาตรฐานแต่ละขวดที่ใช้เตรียมสำหรับสร้างกราฟมาตรฐานนั้นจะมี ผลของเมทริกซ์ของสารตัวอย่างที่เติม (spike) ลงไปอยู่ในปริมาณที่ใกล้เคียงกันมาก จึงทำให้ผลการ วิเคราะห์มีความถูกต้องและน่าเชื่อถือมากขึ้น แต่ก็มีข้อจำกัดเช่นกันคือความเข้มข้นของสารตัวอย่างที่ เติม (spike) ลงไปต้องอยู่ในช่วงความเป็นเส้นตรงในช่วงใช้งาน (linear working range) และสปีชีส์ของ สารตัวอย่างที่เติม (spike) และสารที่สนใจต้องเหมือนกัน นอกจากนี้สารละลายมาตรฐานหนึ่งชุดที่ใช้ สร้างกราฟมาตรฐานจะใช้วิเคราะห์สารตัวอย่างได้เพียงตัวอย่างเดียว จึงทำให้สิ้นเปลืองสารเคมีและ เวลาอย่างมาก แต่ในบางกรณีที่ไม่ต้องการความถูกต้องมากนัก อาจใช้วิธีการเติมแบบสารเดี่ยว (single addition) ในการวิเคราะห์ซึ่งทาได้ง่ายกว่าและประหยัดทั้งเวลาและสารเคมีมากกว่า โดยวิเคราะห์ สารละลายตัวอย่าง ได้สัญญาณ S1 จากนั้นเติมสารละลายมาตรฐานลงในสารตัวอย่าง แล้ววิเคราะห์อีก ครั้งหนึ่ง ได้สัญญาณ S2 นำผลที่ได้จากทั้งสองครั้งมาคำนวณหาความเข้มข้นของสารที่สนใจวิเคราะห์ใน สารตัวอย่าง
